Samen. Leren. Doen.
Verbeteren van de kwaliteit van zorg is een proces van uitvoeren, observeren en leren. Met icu.nl verbinden we evidence-based werkwijzen en toegepast onderwijs.
Om zo samen de beste zorg te kunnen leveren.
Op elke intensive care en dicht bij de patiënt.
Verbeteren van de kwaliteit van zorg is een proces van uitvoeren, observeren en leren. Met icu.nl verbinden we evidence-based werkwijzen en toegepast onderwijs.
Om samen de beste zorg te kunnen leveren.
Op elke intensive care en dicht bij de patiënt.
Leren wat je doet en doen wat je leert
Met het platform van icu.nl maken we evidence-based werkwijzen, geïntegreerd leren en verbetermogelijkheden laagdrempelig toegankelijk op de werkvloer van de intensive care.

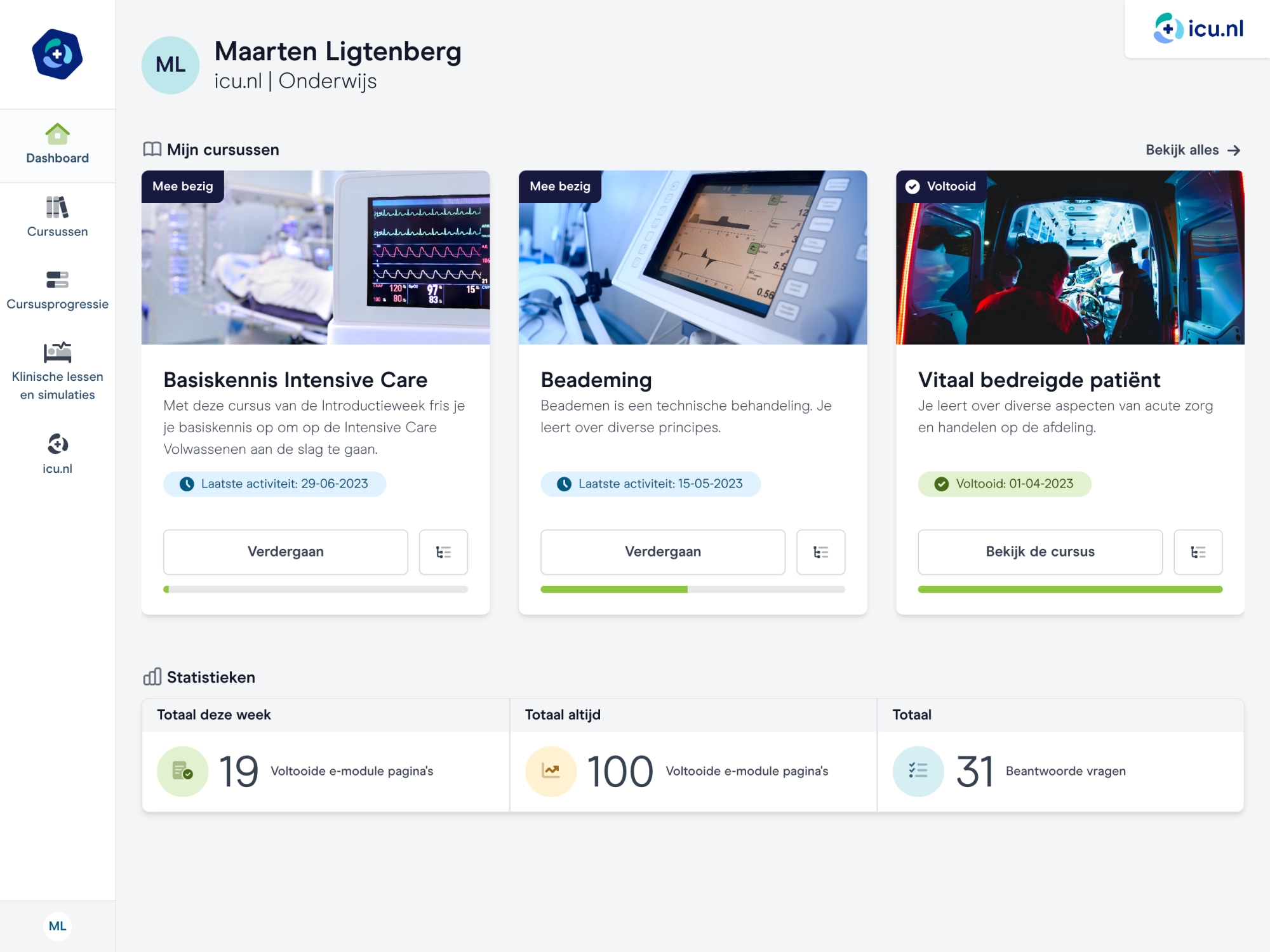
Ons platform voor iedere IC
Bruikbare applicaties en duidelijke inhoud komen samen. Voor jou wordt het zo gemakkelijk mogelijk om te leren en de juiste informatie te vinden.
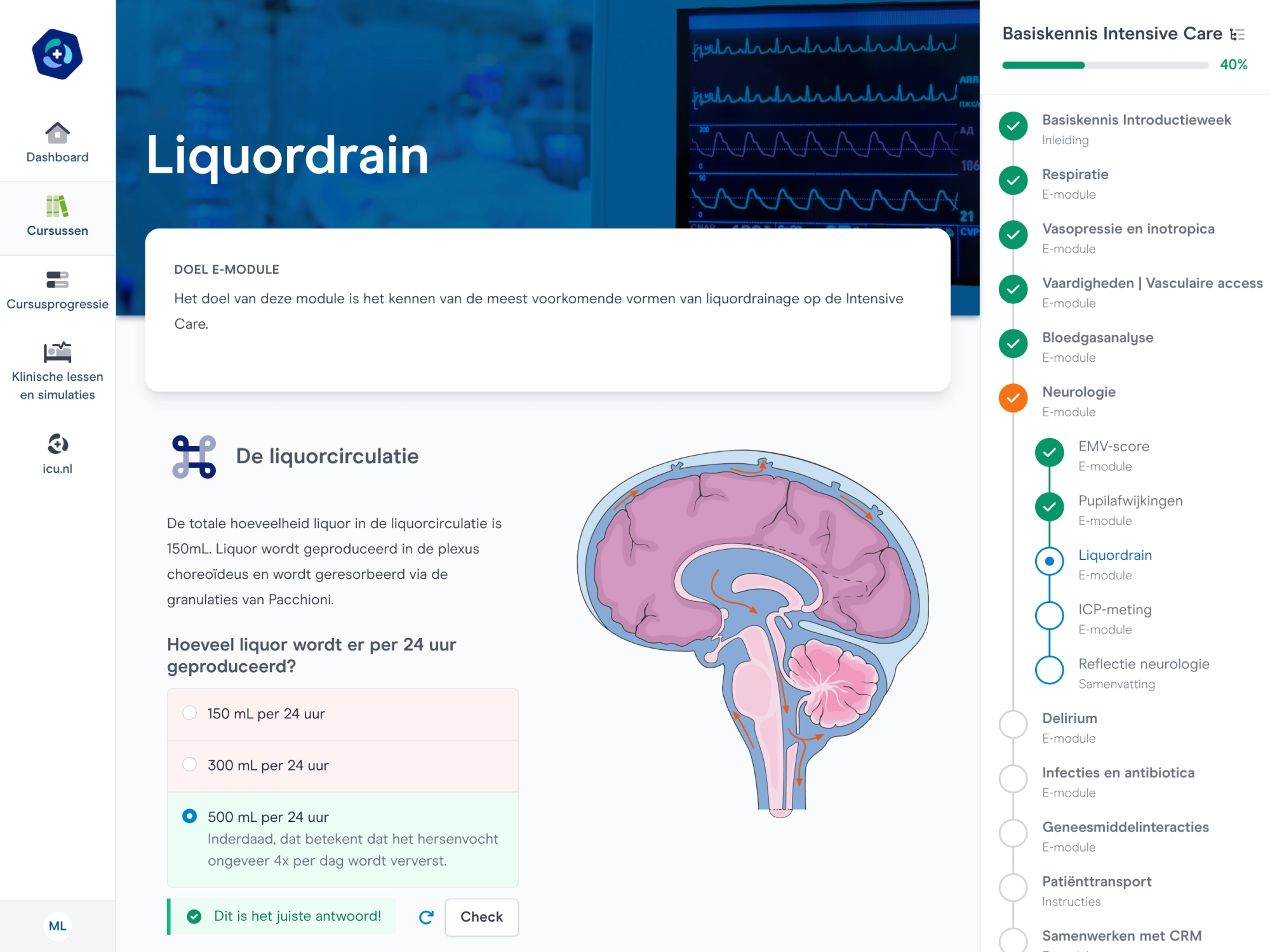
Geïntegreerd leren
Kennis op het moment dat jij het nodig hebt. Altijd en overal.
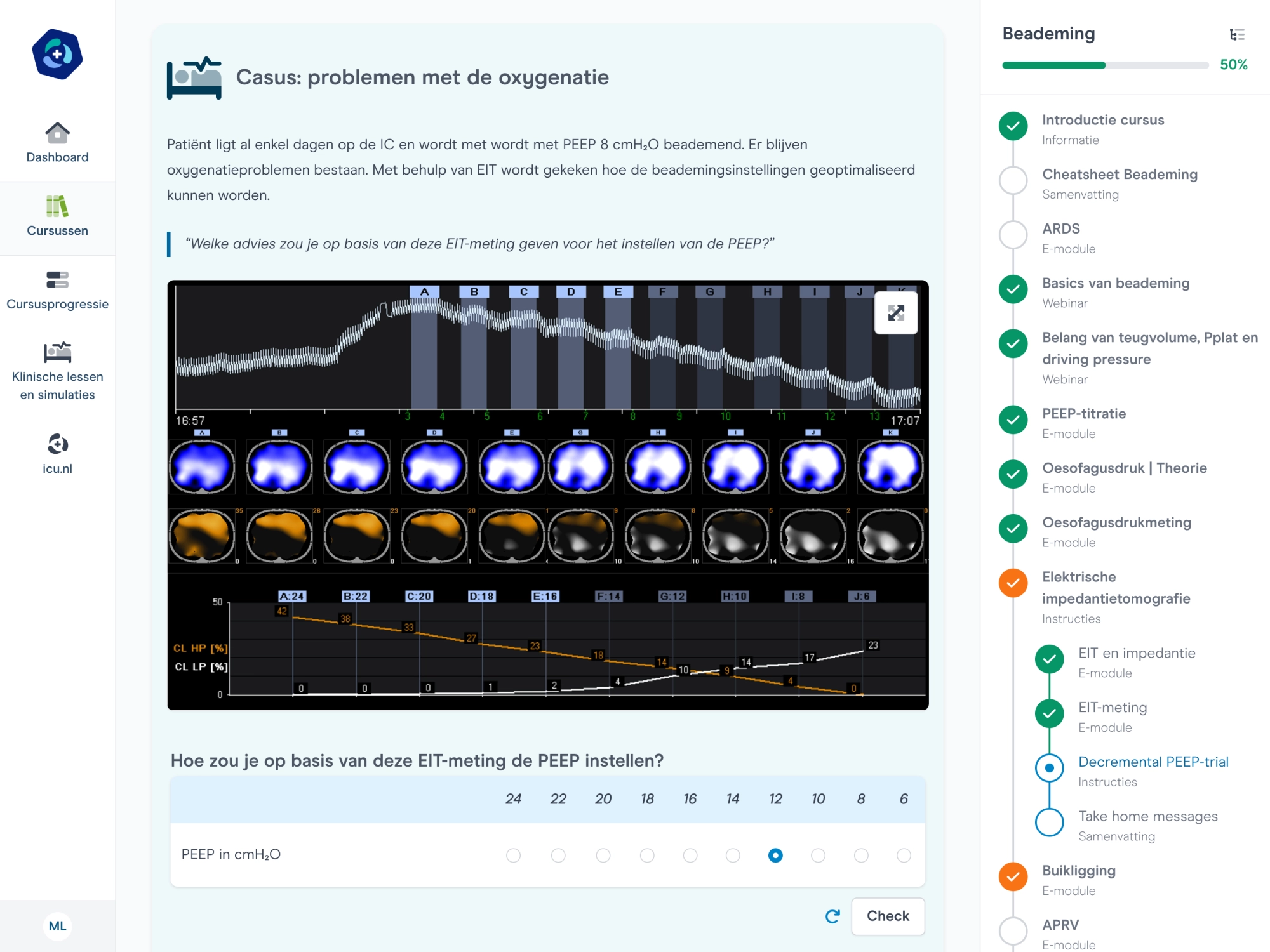
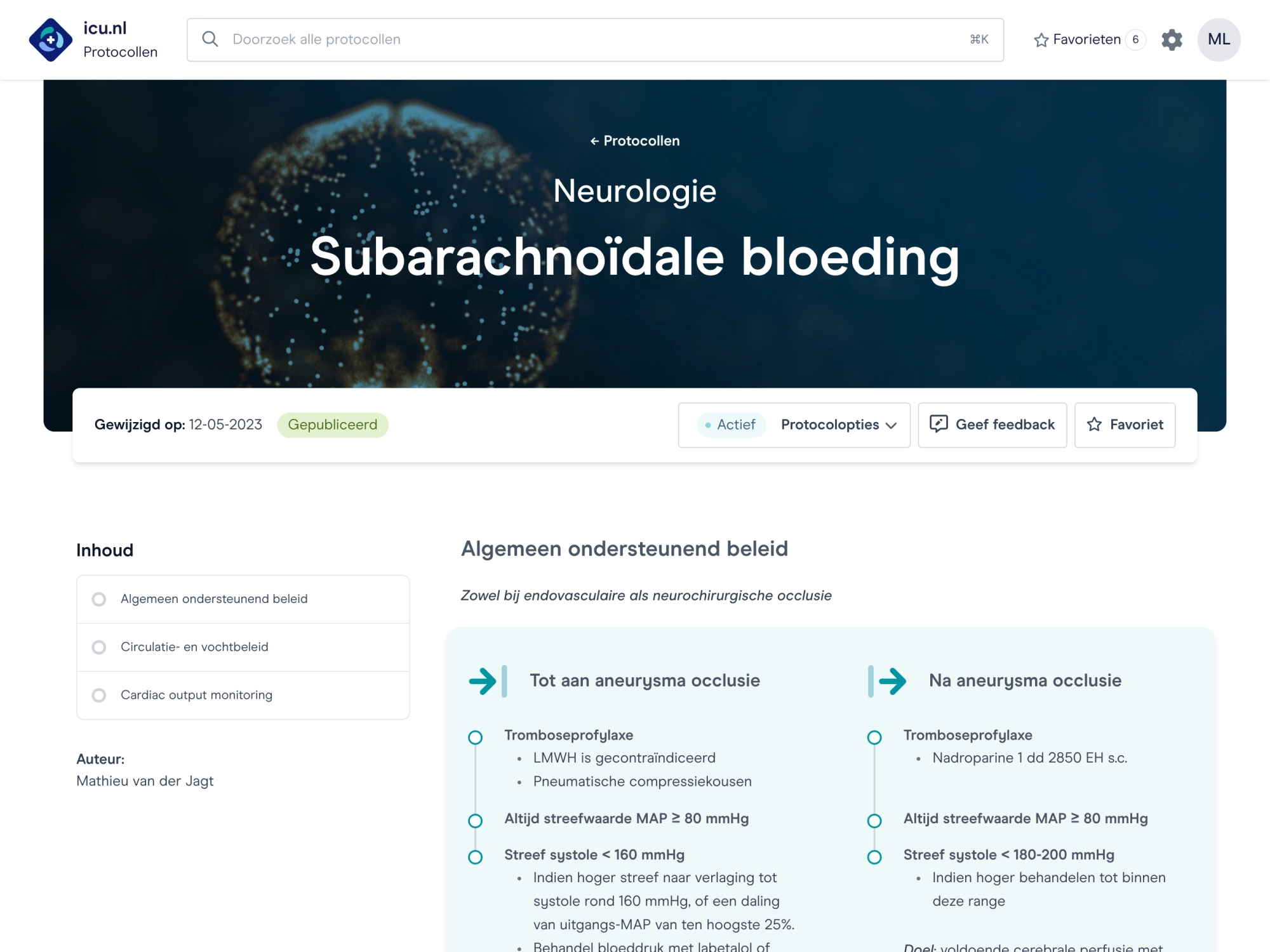
Evidence-based werkwijzen
Vertaling van evidence-based kennis naar praktische werkwijzen.
Evidence-based werkwijzen
Vertaling van evidence-based kennis naar praktische werkwijzen.
Optimalisatie
We maken continue verbetering mogelijk.
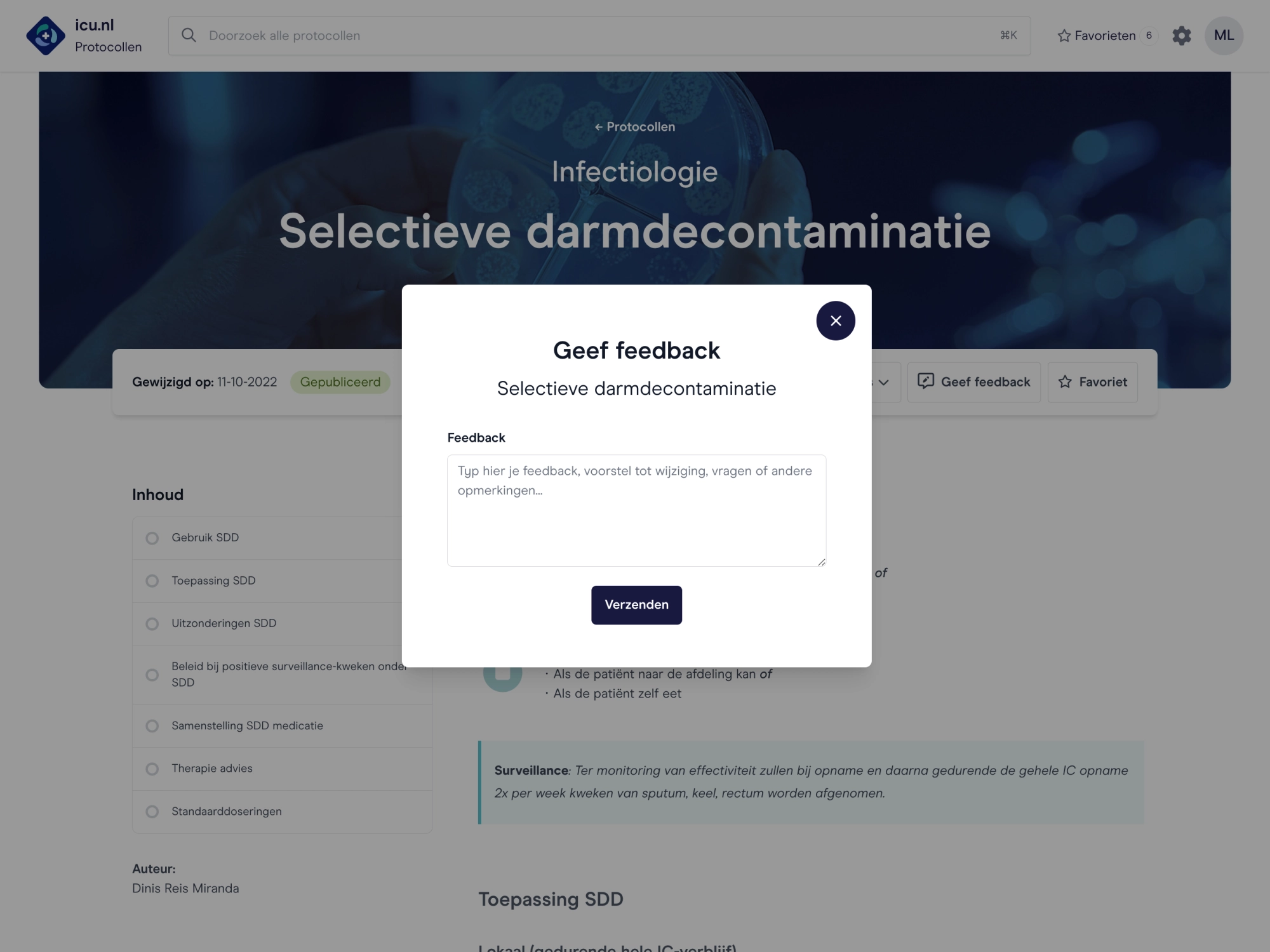
Ook aan de slag met icu.nl binnen jouw organisatie?
We leggen de mogelijkheden uit, zijn benieuwd naar jullie wensen en komen graag bij je langs met een demo.
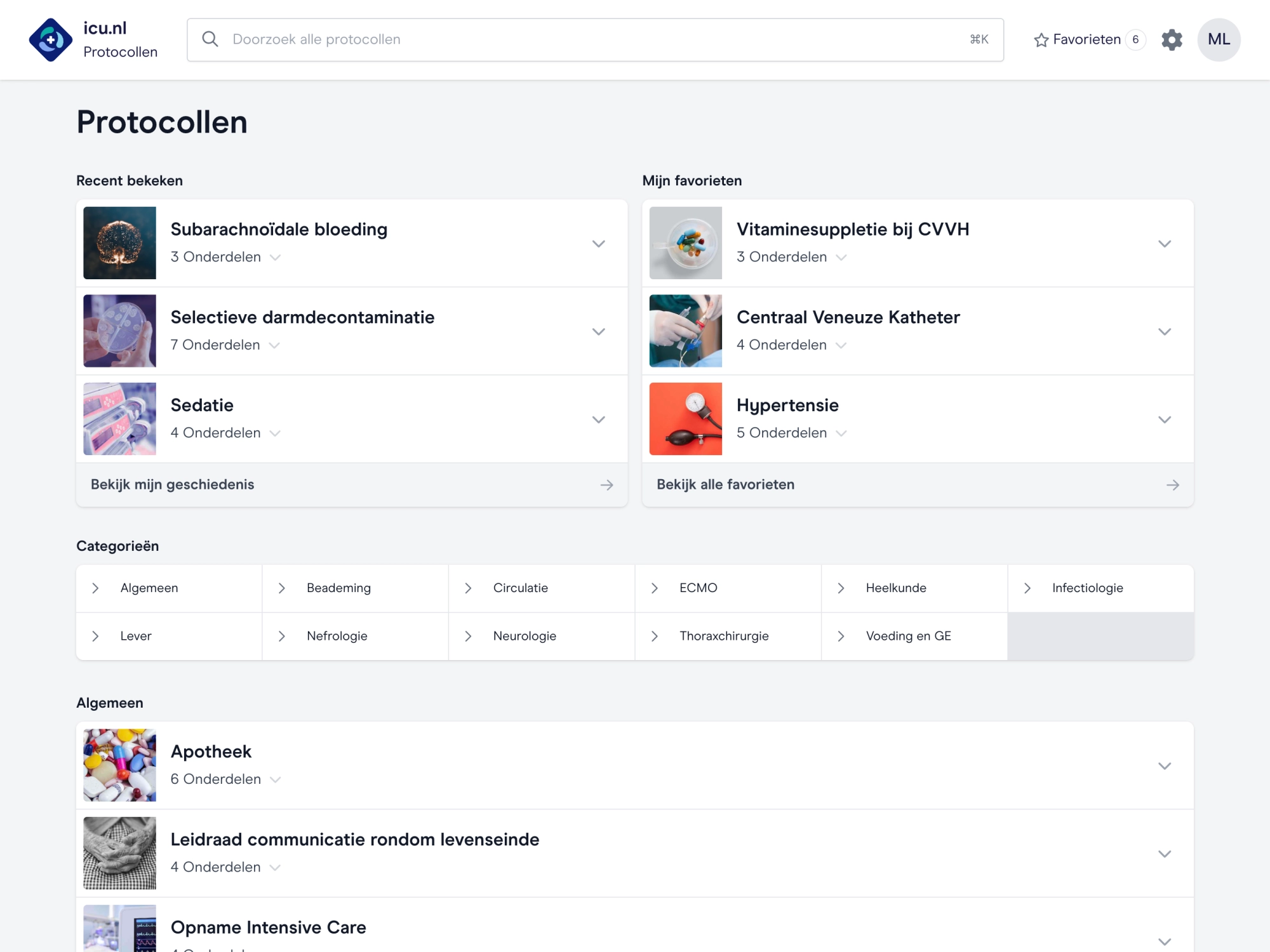
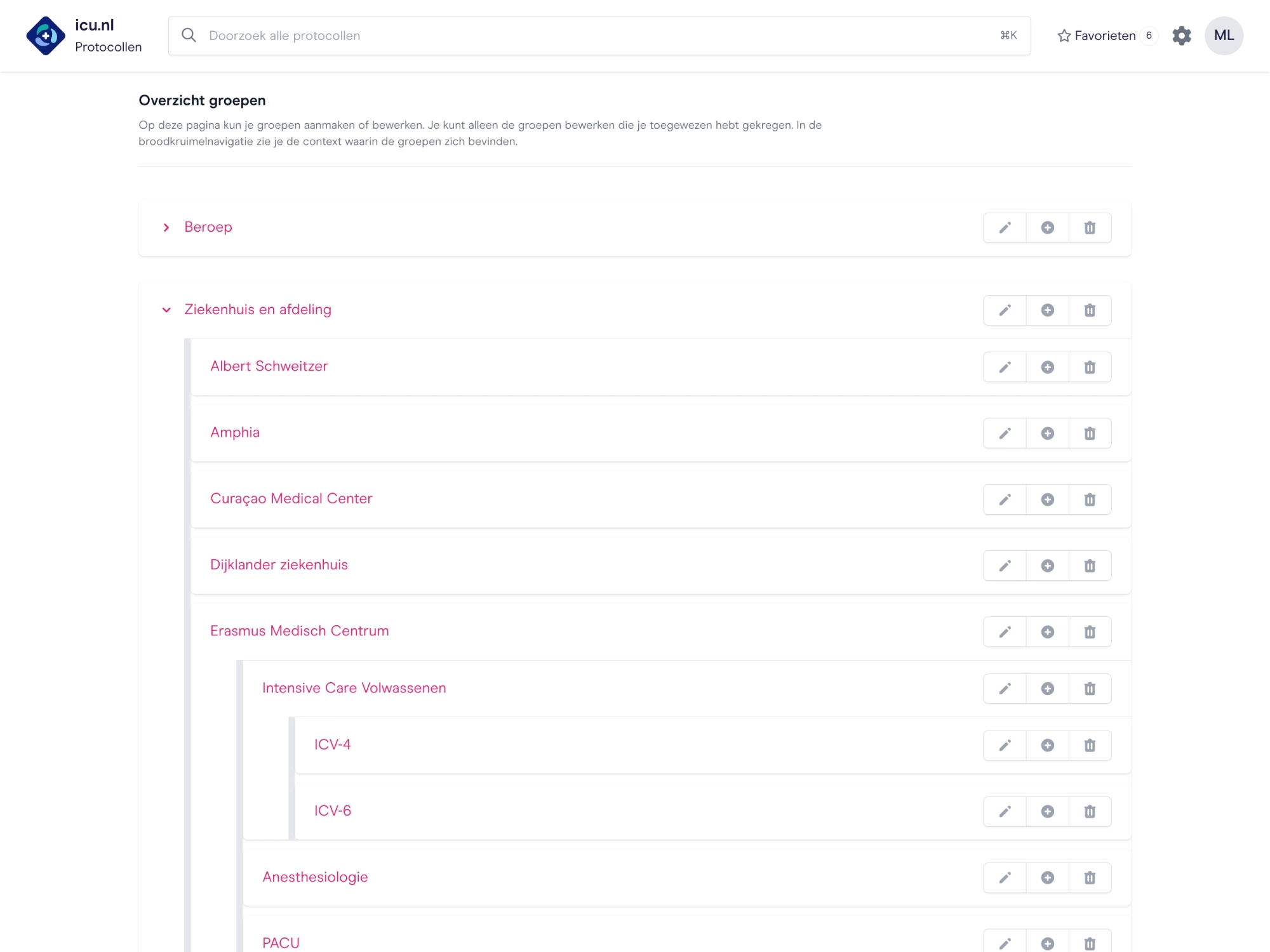
Protocollen voor elkaar
We maken grotendeels gebruik van dezelfde protocollen. Daarbij kunnen jullie eigen protocollen worden toegevoegd aan de icu.nl-applicaties. Alles altijd up-to-date op één plek.
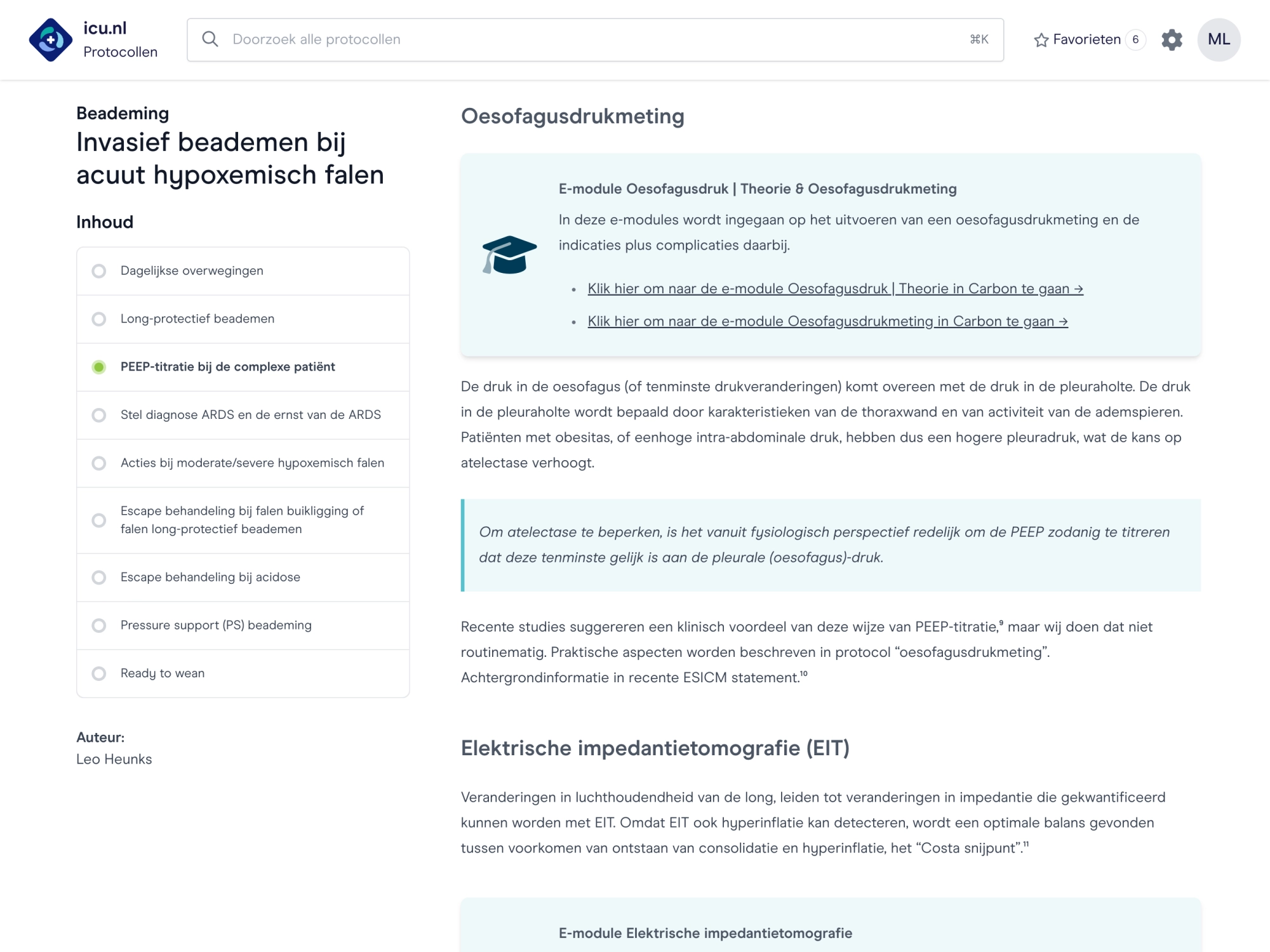
Leren van elkaar
Het onderwijs van icu.nl is direct in te zetten voor ic-verpleegkundigen, arts-assistenten en specialisten. Met diverse onderwerpen zoals beademing, circulatie, echografie en praktische handelingen.
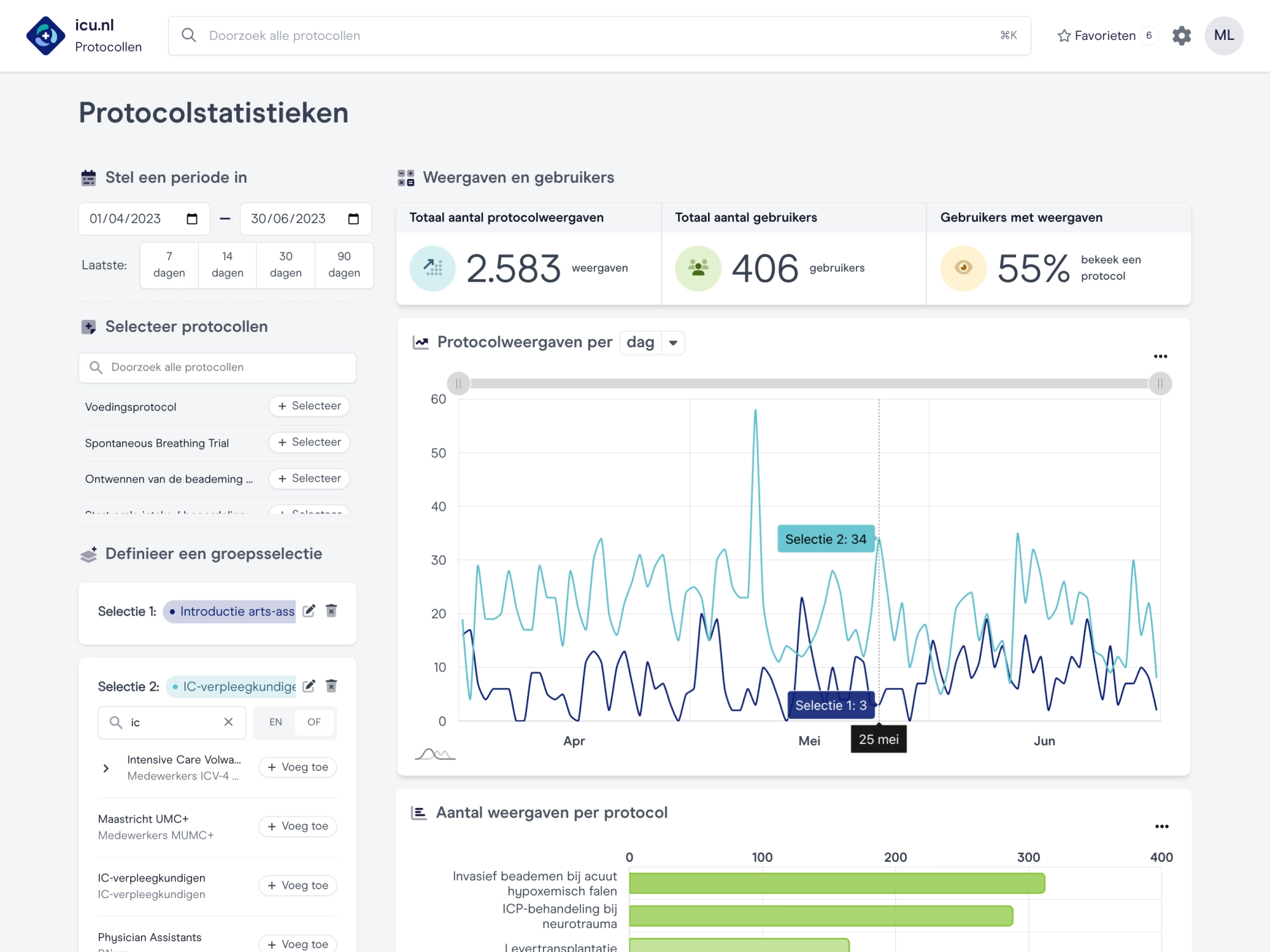
Verbeteren met elkaar
Vanuit de behoefte op de werkvloer en de analyse van de benodigde kennis, ontwikkelen we samen de inhoud voor onderwijs en protocollen daar waar het het meest voor nodig is. Datagedreven en relevant!
"Dankzij de protocollen en educatieve tools van icu.nl maken we de opgedane kennis uit medisch-wetenschappelijk onderzoek praktisch toepasbaar. Hierdoor bieden we de best mogelijke zorg."

"Dankzij de protocollen en educatieve tools van icu.nl maken we de opgedane kennis uit medisch-wetenschappelijk onderzoek praktisch toepasbaar. Hierdoor bieden we de best mogelijke zorg."
Leo Heunks
Professor Intensive Care
Over ons
Als zorgprofessionals op de intensive care streven we ernaar om elke dag - met elkaar - de beste zorg te leveren.
Daarom hebben wij met onze jarenlange ervaring in zorg en onderwijs icu.nl ontwikkeld. Met dit platform helpen we je evidence-based werken naar de patiënt te brengen en kennis en vaardigheden te verbeteren.
Niet met statische inhoud, maar met toegepast onderwijs, beschikbaar op het moment dat je het nodig hebt.
Een platform dat is ontworpen om elkaar te helpen, beter te worden en kennis en ervaring met elkaar te delen. Samen. Leren. Doen.
Doe je mee?
Eva, Jasper, Jubi & Maarten

Jasper van Bommel

Jubi de Haan

Eva Klijn

Maarten Ligtenberg
Wil je ook gebruikmaken van de protocollen? Meld je aan!
Meld je aan om toegang te ontvangen tot de protocollen op
protocol.icu.nl
Maak er gebruik van in je dagelijkse praktijk en ontdek hoe icu.nl ook voor jouw organisatie werkt.
Samen. Leren. Doen. Gelukt!
Hartelijk dank voor je aanmelding en je ontvangt de uitnodiging voor de protocollen op protocol.icu.nl zo spoedig mogelijk. Na 24 uur nog niets ontvangen of andere vragen? Neem dan contact met ons op.
Plan een afspraak in
Benieuwd naar hoe het voor jouw organisatie werkt?